发布时间:2023-02-21 来源:汉光医药 访问次数:


2023年2月15日,广州汉光药业股份有限公司获得国家药品监督管理局关于产品“溴吡斯的明口服溶液”注册上市许可申请《受理通知书》。
溴吡斯的明口服溶液适用于治疗成人和儿童重症肌无力,成人麻痹性肠梗阻。重症肌无力(Myasthenia Gravi, MG)是一种罕见的、慢性自身免疫性疾病,会导致神经肌肉接头传递受损,可不同程度影响眼球运动、吞咽、言语、活动和呼吸功能。我国MG的患病率为8~20/10万,每年新发病例为0.68/10万。
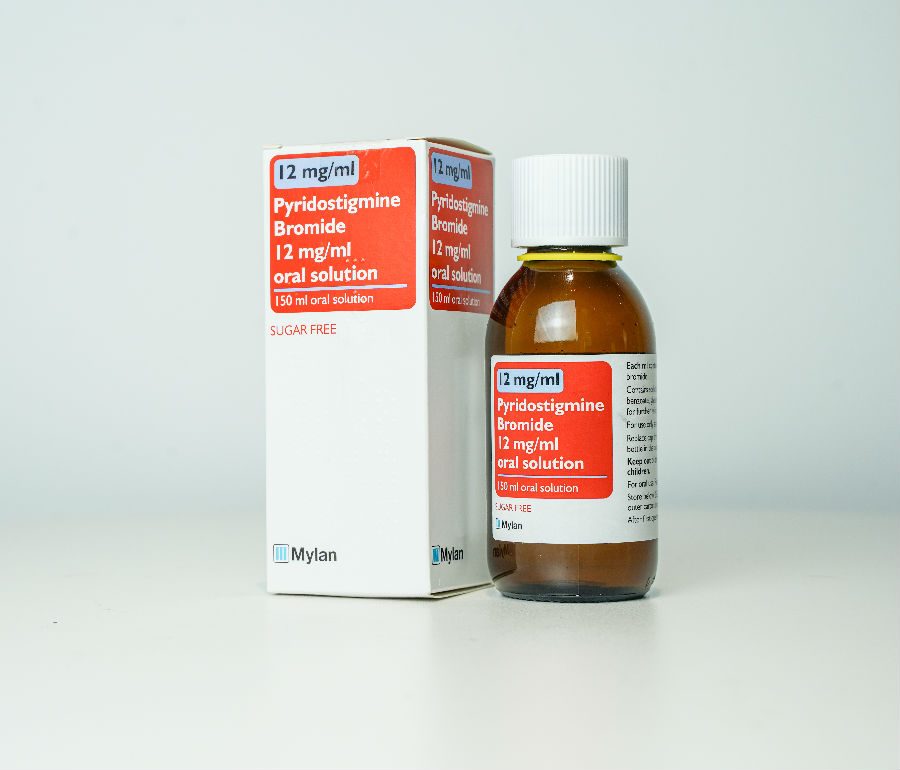
本品属于罕见病药物,全身型重症肌无力已被收载于2018年5月11日国家卫健委等五部门联合发布的《第一批罕见病目录》(序号32)。溴吡斯的明制剂被纳入2019年9月17日国家卫健委等五部门联合发布的《第一批鼓励仿制药品目录建议清单》(序号21)。此外,溴吡斯的明制剂被纳入2020年12月30日国家卫生健康委员会等12部门联合发布的《国家临床必需易短缺药品重点监测清单》(序号5)。
目前国内尚无溴吡斯的明口服溶液剂型获批上市。本品的引进除了可缓解该临床必需且易短缺的药品供应问题以外,更为国内儿童患者和吞咽困难患者提供一种新的用药选择,无疑为重症肌无力患者带来福音。
近年来,我们党中央和国务院非常重视提高罕见病用药的可及性,2018年5月,国家卫健委、科技部、工信部、国家中医药管理局等5部门印发《第一批罕见病目录》,首次以目录形式界定了哪些为罕见病。但是罕见病用药面临的最严峻的问题之一就是市场机制失灵,如何激励企业为少数患者提供和生产药品,同时还能获得可持续发展是罕见病领域特有的挑战。汉光药业就是在国家的感召下,感受到这是我们的使命和责任。
汉光药业公司介绍

广州汉光药业股份有限公司(下称“公司”)成立于2005年,是一家集高端药品研发、全球引进、生产和营销为一体的创新型医药企业,公司被认定为“国家级高新技术企业”、“两高四新(专精特新)企业”、“纳税信用A级纳税人”,曾先后获得“广东省医药行业创新型优秀企业”、“广东省创新发展示范企业”、“广东省守合同重信用企业”、“广东省专精特新中小企业(2022)”、“广东省创新型中小企业”、“2021中国医药互联网创新发展领潮企业”、“头部力量·中国医药高质量发展成果企业(2021)”、“头部力量·中国医药高质量发展成果企业(2022)”、“2022中国医药社会责任媒体观察——公益柱石奖”等荣誉,荣登“广东创新能力500强”、“中国非处方药生产企业综合统计排名前百强”等榜单。

